エステルおよびアミドは最も一般的かつ重要な官能基であり、その制御は有機合成のみならず生命現象解明のためにも非常に重要です。我々は、エステル結合およびアミド結合の自在制御を目的とし、環境調和性が高く、基質一般性の広い触媒反応の開発に取り組んでいます。
生体内でアミノペプチダーゼが金属二核構造を触媒活性点に有するように、「複数の金属によってカルボニル化合物とアルコール、あるいはカルボニル化合物とアミンを位置固定と活性化すること」を触媒開発のコンセプトとしました。
このようなコンセプトのもと、我々は亜鉛四核クラスター ( STREMから市販、商品名ZnTAC24 ) を合成し、エステル交換反応の優れた触媒となることを見出しました。この亜鉛四核クラスター触媒は高度に基質を活性化し、穏やかな条件化で反応を進行させるため官能基共存性に優れており、特に注目されることは、求核性が高いアミノ基が存在しても水酸基を選択的にアシル化することができる点です。このような官能基選択的反応は、これまでリパーゼを用いた例が知られているのみであり、人工触媒を用いた初めての例です。また、このような亜鉛四核クラスター触媒の特長を活かし、酢酸エチルをアセチル源とした水酸基選択的なアセチル化反応を開発し、さらに、溶媒をメタノールに変更するのみで逆反応である脱アセチル化反応の開発にも成功しました。さらに近年、我々は亜鉛四核クラスターの触媒活性を向上させる配位子を発見し、本クラスター触媒の適用範囲の拡大に成功しています。
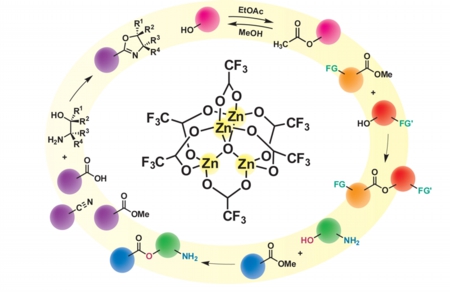
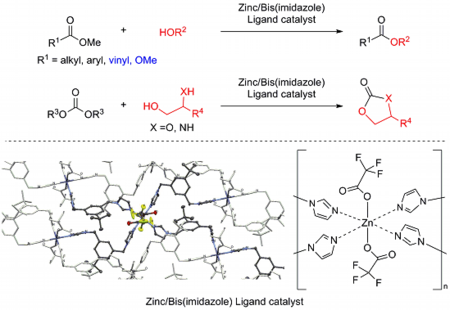
また、我々は独自の配位子設計を行い、亜鉛四核クラスターの改良版である亜鉛・ビスイミダゾール配位子錯体を開発しました。この亜鉛錯体は空気下において非常に安定で、亜鉛四核クラスターよりも高い触媒活性や耐水性、水酸基選択性を示しました。
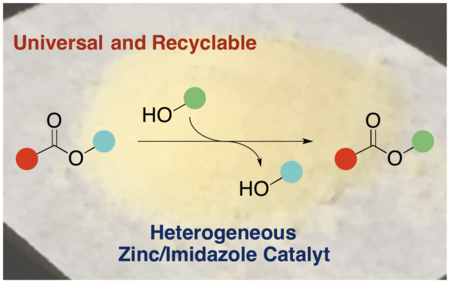
さらに我々は最新の研究で、亜鉛触媒の不均一触媒化を達成しました。この不均一亜鉛触媒は、従来の亜鉛四核クラスターや亜鉛錯体と同様に広い官能基共存性や高い水酸基選択性を示し、複雑な構造を有する医薬品の合成にも応用可能でした。また、ろ過操作によって触媒の回収を容易に行えるだけでなく、複数回の再利用を行う事が可能でした。
今後、この不均一亜鉛触媒を応用して、高級エステル化合物を連続的に合成するフロー合成系を確立したいと思います。
<代表論文>
オキサゾリン合成 Ohshima, T.; Iwasaki, T.; Mashima, K. Chem. Commun. 2006 , 2711 . DOI: 10.1039/B605066B
エステル交換反応 Iwasaki, T.; Maegawa, Y.; Hayashi, Y.; Ohshima, T.; Mashima, K. J. Org. Chem. 2008 , 73 , 5147. DOI: 10.1021/jo800625v
O-選択的アシル化反応 Ohshima, T.; Iwasaki, T.; Maegawa, Y.; Yoshiyama, A.; Mashima, K. J. Am. Chem. Soc . 2008 , 130 , 2944. DOI: 10.1021/ja711349r
フラン環合成 Sniady, A.; Durham, A.; Morreale, M. S.; Marcinek, A.; Szafert, S.; Lis, T.; Brzezinska, K. R.; Iwasaki, T.; Ohshima, T.; Mashima, K.; Dembinski, R. J. Org. Chem. 2008 , 73 . 5881. DOI: 10.1021/jo8007995
アセチル化反応 Iwasaki, T.; Maegawa, Y.; Hayashi, Y.; Ohshima, T.; Mashima, K. Synlett 2009 , 1659. DOI: 10.1055/s-0029-1217335
脱アセチル化反応 Iwasaki, T.; Agura, K.; Maegawa, Y.; Hayashi, Y.; Ohshima, T.; Mashima, K. Chem. Eur. J. 2010 , 16 , 11567. DOI: 10.1002/chem.201000960
配位子添加効果
Maegawa, Y.; Ohshima, T.; Hayashi, Y.; Agura, K.; Iwasaki, T.; Mashima, K. ACS Catal. 2011, 1, 1178–1182. DOI: 10.1021/cs200224b
亜鉛-ビスイミダゾール配位子錯体
Daiki Nakatake, Yuki Yokote, Yoshimasa Matsushima, Ryo Yazaki, Takashi Ohshima Green Chem. 2016 , 18 ,1524 – 1530 . DOI: 10.1039/C5GC02056E
不均一亜鉛触媒
Daiki Nakatake, Ryo Yazaki, Yoshimasa Matsushima, Takashi Ohshima Adv. Synth. Catal. 2016 , 3 58 , 2569–2574 .
DOI: 10.1002/adsc.201600229 (Press Release, Highlighted by Synfacts 2016 , 12 , 1206. DOI: 10.1055/s-0036-1589328 )
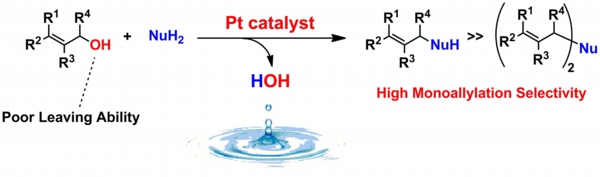
アリル化合物は二重結合部位を利用して様々な変換反応が可能であり、様々な生物活性化合物の合成に利用されています。このようなアリル化合物の最も一般的な合成法として、入手容易なアリルアルコールからの変換反応が挙げられます。しかしながら、アリルアルコールはその水酸基の脱離能の低さのために、あらかじめ等モル量以上の試薬を用いて活性化されたアリルアルコール誘導体へと変換する必要がありました。さらに、活性化の前後で不要な廃棄物も副生するため、環境調和の観点から改善が望まれていました。
一方、我々の新規触媒反応開発の結果、白金触媒を用いることでアリルアルコールの直接アミノ化反応を実現することができました。この場合、触媒的にアリルアルコールを活性化して直接反応に用いるため、従来法に比べて反応工程を短縮でき、さらに反応の共生成物は水のみとなるため、環境にも優しい反応であります。また、この触媒系は従来の触媒系とは異なり、求核性の高いアミンを用いた場合にもモノアリル体を高選択的に得ることがわかっており、芳香族・脂肪族アミンだけでなくアンモニアを用いることで、それぞれ第 2 級、第 1 級アミンの選択的合成に初めて成功しています。現在我々は本触媒系の利用価値をさらに高めるため、不斉反応への展開やフローシステムへの応用、天然物の全合成などを検討しています。
<代表論文>
Masaru Utsunomiya, Yoshiki Miyamoto, Junji Ipposhi, Takashi Ohshima,* and Kazushi Mashima*
Direct Use of Allylic Alcohols for Platinum-Catalyzed Monoallylation of Amines
O rg. Lett. 2007 , 9 , 3371. DOI: 10.1021/ol071365s
Takashi Ohshima*, Yoshiki Miyamoto, Junji Ipposhi, Yasuhito Nakahara, Masaru Utsunomiya and Kazushi Mashima*
Platinum-Catalyzed Direct Amination of Allylic Alcohols under Mild Conditions: Ligand and Microwave Effects, Substrate Scope, and Mechanistic Study
J. Am. Chem. Soc. 2009 , 131 , 14317. DOI: 10.1021/ja9046075
Das, K.; Shibuya, R.; Nakahara, Y.; Germain, N.; Ohshima, T.; Mashima, K.
Platinum-Catalyzed Direct Amination of Allylic Alcohols with Aqueous Ammonia for Selective Synthesis of Primary Allylamines.
Angew. Chem. Int. Ed. 2012 , 51 , 150–154. DOI: 10.1002/anie.201106737
Ryozo Shibuya, Lu Lin, Yasuhito Nakahara, Kazushi Mashima, Takashi Ohshima
Dual Platinum and Pyrrolidine Catalysis in the Direct Alkylation of Allylic Alcohols: Selective Synthesis of Monoallylation Products
Angew. Chem. Int. Ed., 2014 , 53 , 4377–4381. DOI: 10.1002/anie.201311200
Ming Zhang, Kenji Watanabe, Masafumi Tsukamoto, Ryozo Shibuya, Hiroyuki Morimoto, Takashi Ohshima
A Short Scalable Route to (−)-α-Kainic Acid Using Pt-Catalyzed Direct Allylic Amination
Chem. Eur. J. 2015 , 21 , 3937–3941. DOI: 10.1002/chem.201406557
カルボニル化合物に対する不斉アルキニル化反応は、合成素子として重要なプロパルギル化合物を合成する有用な反応です。しかし、不斉水素化で合成困難な不斉四置換炭素を構築するケトン・ケチミン(ケトン由来イミン)に対する反応は一般的に当量以上の金属塩基試薬を用いる必要があり、原子効率・官能基共存性の観点で問題を残していました。
我々は、西山らによって開発されたRh-Phebox錯体が、ケトン・ケチミンの直接的触媒的不斉アルキニル化反応の優れた触媒として機能することを見出しました。本反応は末端アルキンを強塩基等で事前活性化することなく直接求核剤として用いることが可能であり、高原子効率・広い官能基共存性で不斉四置換炭素含有プロパルギル化合物を得ることに成功しました。
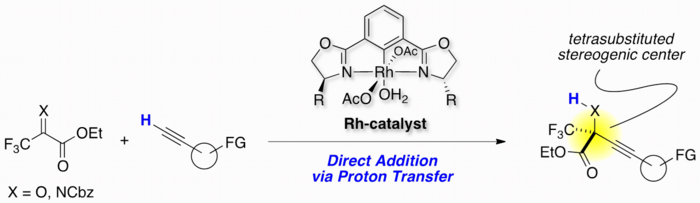
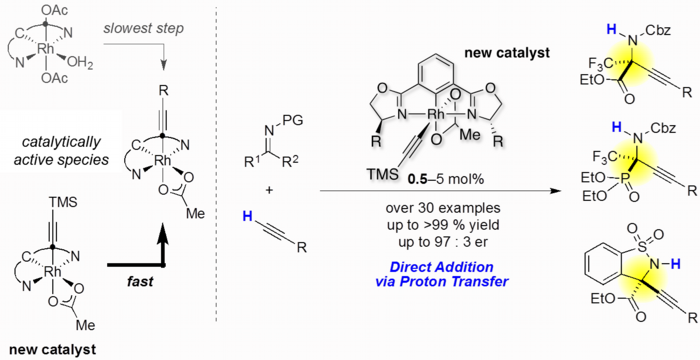
また、本反応の詳細な反応機構解析を行い、「活性種であるアルキニルロジウム種の形成が反応活性に重要であること」「末端アルキンがプロトン源として働くこと」など触媒反応開発に重要な知見を得ることに成功しました。また、得られた知見を基により高活性な触媒を開発し、基質一般性の拡大を達成しました(論文3)。
<代表論文>
Ohshima, T.; Kawabata, T.; Takeuchi, Y.; Kakinuma, T.; Iwasaki, T.; Yonezawa, T.; Murakami, H.; Nishiyama, H.; Mashima, K.
C1-Symmetric Rh-Phebox-Catalyzed Asymmetric Alkynylation of α-Keto Ester.
Angew. Chem. Int. Ed.
2011 , 50 , 6296-6300. DOI: 10.1002/anie.201100252
(Highlighted by Synfacts
2011 , 9 , 967. DOI: 10.1055/s-0030-1261004 (SYNFACTS of the month))
Kazuhiro Morisaki, Masanao Sawa, Jun-ya Nomaguchi, Hiroyuki Morimoto, Yosuke Takeuchi, Kazushi Mashima, Takashi Ohshima
Rh-Catalyzed Direct Enantioselective Alkynylation of α-Ketiminoesters
Chem. Eur. J. 2013 , 19 , 8417-8420. DOI: 10.1002/chem.201301237
(Highlighted by Synfacts
2013 , 9 , 976. DOI: 10.1055/s-0033-1339603 )
Kazuhiro Morisaki, Masanao Sawa, Ryohei Yonesaki, Hiroyuki Morimoto, Kazushi Mashima, Takashi Ohshima
Mechanistic Studies and Expansion of the Substrate Scope of Direct Enantioselective Alkynylation of α-Ketiminoesters Catalyzed by Adaptable (Phebox)Rh(III) Complexes
J. Am. Chem. Soc . 2016 ,
138 , 6194–6203 . DOI: 10.1021/jacs.6b01590
(Press Release, Highlighted by Chem-Station )
アミドは古くからアミノ基の保護に用いられ、重要な保護基として利用されてきました。近年では、C–H結合の活性化や速度論的光学分割などに利用され、その重要性はさらに高まっています。従って、アミド結合の切断は様々な有用なアミンの合成へと繋がるため、アミン合成において有用な反応です。しかし、アミド結合はその安定性の高さから、切断には一般に強酸や強塩基を用いる激しい反応条件が必要なため、用いることの出来る基質に制限がありました。我々はこういった問題点を解決すべく、求核剤にアミンを用いるトランスアミド化反応を利用し、温和な条件下でのアミド切断反応の開発に取り組んでいます。
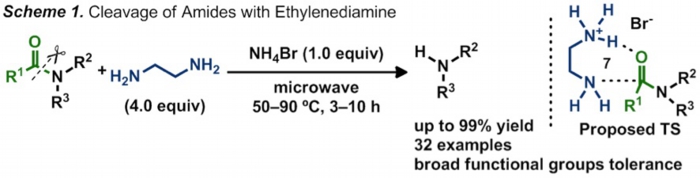
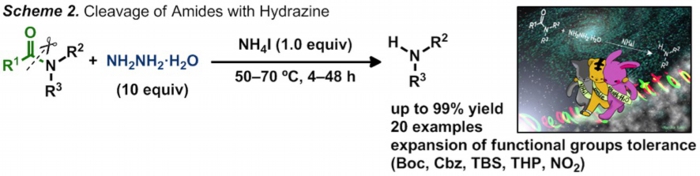
我々は、以前に報告したPt触媒を用いるアミノアルコールの直接アミノ化反応で観測された副反応について徹底的な検討を行い、エチレンジアミンと臭化アンモニウム塩という非常に簡単な組み合わせがアミド結合の切断に高い反応性を示すことを見つけました(Scheme 1)。また、より高い求核性を有するヒドラジンを求核剤に用いることで、より低温条件下でのアミド結合の切断を達成しました(Scheme 2)。これらの反応は高い立体障害を有する基質や従来法では共存困難な官能基を有する基質にも適用可能です。また、用いる試薬は特別な精製を必要とせず、空気下や水存在下で反応を行っても問題なく進行するため、ハンドリングも非常に容易です。
一方で、カーバメートやウレアは医薬品や農薬などの生物活性物質や、有機化合物の合成中間体に広くみられる重要な構造の1つです。しかし、アミドと同様にカーバメートやウレア結合はその安定性の高さから一般に切断が困難であり、従来法では用いることの出来る基質に制限がありました。我々は最近の研究で、ジエチレントリアミンを求核剤に用いたカーバメートやウレアの切断反応の開発を達成しました(Scheme 3)。本反応は従来法では共存困難な官能基を有する化合物へも適用可能です。更に、類似の構造であるアミド結合存在下においても、カーバメートやウレアを選択的に切断できるという、これまでにない興味深い化学選択性も見出しました。
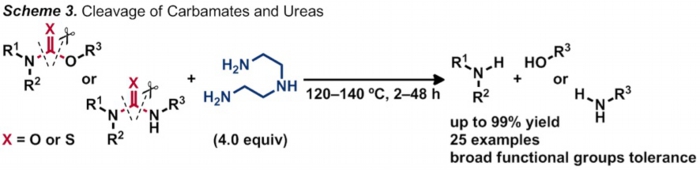
<代表論文>
Yuhei Shimizu, Hiroyuki Morimoto, Ming Zhang, Takashi Ohshima
Microwave-Assisted Deacylation of Unactivated Amides to Amines Using Ammonium Salt-Accelerated Transamidation.
Angew. Chem. Int. Ed. 2012 , 51 , 8564. DOI: 10.1002/anie.201202354
Yuhei Shimizu, Megumi Noshita, Yuri Mukai, Hiroyuki Morimoto, Takashi Ohshima
Cleavage of unactivated amide bonds by ammonium salt-accelerated hydrazinolysis
Chem. Commun. 2014 , 50 , 12623 –12625 . DOI: 10.1039/C4CC02014F (Backcover)
Megumi Noshita, Yuhei Shimizu, Hiroyuki Morimoto, Takashi Ohshima
Diethylenetriamine-Mediated Direct Cleavage of Unactivated Carbamates and Ureas
Org. Lett. , 2016 , 18 , 6062–6065. DOI: 10.1021/acs.orglett.6b03016
大嶋孝志、森本浩之、清水悠平 特願2012-46588
既存医薬品には、アミノ基と水酸基両方持つ分子が多く存在しています。既存のいや鵜品を合成終盤にて修飾する手法は、新たな医薬品を探索する手法とし近年注目されていますが、アミノ基は水酸基より求核性が高く、求電子剤と反応させる際、水酸基のみを選択的に反応させる事は困難です。そのため、通常、アミノ基の保護/脱保護を経る事で、水酸基変換体の合成がなされています。本手法では、保護基の脱着に伴う反応工程数・廃棄物の増加が問題としてあげられます。そのため触媒的に水酸基の選択的な活性化が可能となれば、アミノ基の保護を経る必要がなくなり、医薬品などの複雑な分子を用いても、迅速に水酸基変換体の合成ができるため、応用性の高い環境調和性に優れた手法となります。
このような背景からアミノ基共存下における触媒的な水酸基選択的反応は、近年注目されています。それに対し、我々は、ソフトLewis酸/ハードBrønsted塩基を触媒として用いることで、廃棄物を生じない、アミノ基共存下における触媒的な水酸基選択的共役付加反応を開発しました。また、不飽和スルホニル化合物を用いることで、直接的に多様な官能基を導入でき、触媒的な無保護アミノアルコールの水酸基修飾法を開発することに成功しました。さらに、無保護アミノジオールに対して、化学選択的かつ位置選択的な特定な水酸基を選択的な修飾方の開発にも成功しました。 アミノアルコール骨格を持つ医薬品の水酸基へ官能基を選択的に導入できるため、本研究によりの化学修飾した既存薬から、新たな医薬品を開発することが期待されます。
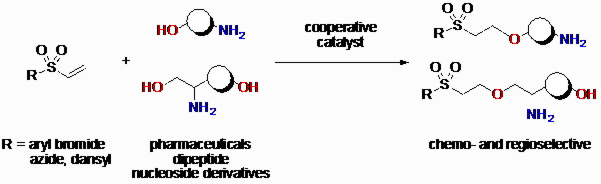

<代表論文>
Shuhei Uesugi, Zhao Li, Ryo Yazaki, Takashi Ohshima
Chemoselective Catalytic Conjugate Addition of Alcohols over Amines
A ngew. Chem. Int. Ed. , 2014 , 53 , 1611–1615. DOI: 10.1002/anie.201309755
Zhao Li, Ryo Yazaki, Takashi Ohshima
Chemo- and Regioselective Direct Functional Group Installation through Catalytic Hydroxy Group Selective Conjugate Addition of Amino Alcohols to α,β-Unsaturated Sulfonyl Compounds
Org. Lett. 2016, 18 , 3350–3353 . DOI: 10.1021/acs.orglett.6b01464
エステルは天然物や有機合成化合物に多く含まれる重要な官能基であり、これまでにその合成方法が盛んに研究されてきました。種々の合成方法の中でも、触媒を用いた化学選択的なエステル交換反応は環境調和性の面で優れている反応であり、当研究室の亜鉛四核クラスター触媒をはじめ、いくつかの触媒によって達成されています。しかし、選択性の制御が困難な活性エステルや立体障害の大きい三級アルコールへの適用は困難であり、その報告例は少ないものとなっています。
今回我々はFe-salen錯体が化学選択的なエステル交換反応に高い活性を有していることを見出しました。条件を検討した結果、本錯体は選択性の制御が困難な活性エステルや立体障害の大きい三級アルコールを用いた場合においても高収率で目的物を得ることに成功しました。また、本錯体は合成化学上有用なtert-ブチルエステルや医薬品誘導体の合成への応用も可能であり、
合成化学・創薬化学の分野において有用な反応と成り得ます。
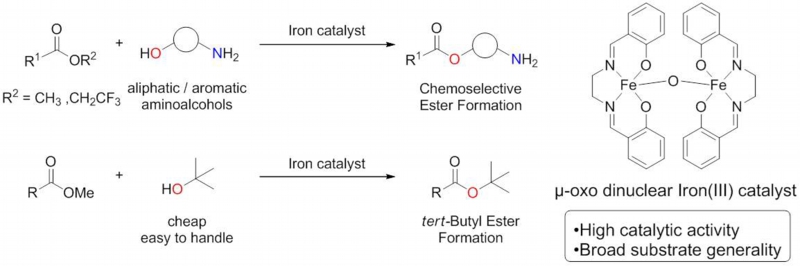
<代表論文>
Rikiya Horikawa, Chika Fujimoto, Ryo Yazaki, Takashi Ohshima
μ-Oxo-Dinuclear Iron(III) Catalyzed O-Selective Acylation of Aliphatic and Aromatic Amino Alcohols and Transesterification of tert-Alcohols
Chem. Eur. J. 2016 , 22 , 12278–12281 . DOI: 10.1002/chem.201602801 (Press Release)
大嶋孝志、矢崎亮、藤本千佳、堀河力也 特願 2014-069713
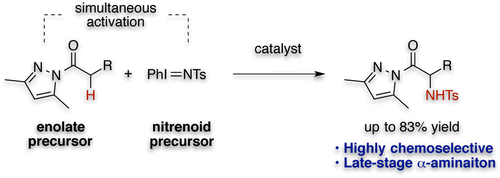
近年ペプチド医薬品が副作用の少なさや薬効の高さのため注目されています。しかし、その構成成分である非天然型α-アミノ酸は生体内で生合成されないため、人工的な有機合成による供給が必須です。そのため今までに数多くのアミノ酸合成反応が報告されてきましたが、その多くはイミンにシアノ基を付加させるStreckerタイプの反応、もしくはグリシン誘導体のアルキル化という炭素-炭素結合を形成する反応でした。一方カルボン酸等価体のα位を直接的にアミノ化する手法は、あらかじめ炭素骨格を構築し、極性官能基を導入するLate-Stage Functionalizationにも適応可能で、α-アミノ酸合成法として有用です。しかしこのような反応は通常、事前活性化が必須で、またその基質一般性にも改善の余地が残されていました。そこで今回我々は、温和な反応条件下、幅広い基質一般性を有するカルボン酸等価体の直接的化学選択的α位アミノ化反応の開発に着手しました。
通常エステルやアミドのようなカルボン酸等価体のα位のプロトンの酸性度は低く温和な条件でのエノラートの形成は難しいと考えられます。そこで我々は、カルボン酸等価体としてN-アシルピラゾールに着目しました。アシルピラゾールのα位水素は、ピラゾール環の芳香族性に起因した高い酸性度を示し、その酸性度は、ケトンと同程度になっています。
更にアシルピラゾールを活性化するためにLewis酸を用いる事にしました。Lewis酸はピラゾール環上の窒素原子とカルボニル基の酸素原子との5員環キレート構造を形成し、側鎖にケトンやエステル等の他のカルボニル基共存下においても化学選択的にアシルピラゾールのエノラート化が進行すると考えました。
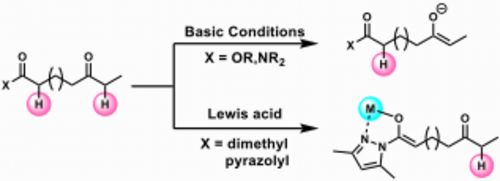
そこで我々はこの N -アシルピラゾールとLewis酸、求電子的アミノ化試薬を用いることで N -アシルピラゾールのα位をアミノ化する事が可能ではないかと考え、検討を行ったところ、銅触媒存在下、求電子的アミノ化試薬としてイミノヨージナンを用いることで温和な条件下α-アミノ化反応が進行することを見出しました。本反応は幅広い官能基許容性を有しており、特にアシルピラゾールよりα位の酸性度の高いニトロアルキル基やケトン等の電子求引基を分子内に有する基質においても N -アシルピラゾールのα位で化学選択的にアミノ化反応を進行させることに成功しました。また、本反応は従来法では用いる事の出来ない複雑な炭素骨格を有する,生体内分子由来のカルボン酸等価体に対してもアミノ化可能で、医薬品や天然物の誘導体合成を行う際にも有用だと考えられます。更に本反応で合成したアミノ酸誘導体はカルボン酸だけでなく、エステルやアミド、ケトンやアルデヒドなど様々な官能基へ高収率で変換する事も可能です。また一般的に脱保護が難しいとされているトシル基についても、極めて高収率での脱保護にも成功しています。
<代表論文>
Keisuke Tokumasu, Ryo Yazaki, Takashi Ohshima
Direct Catalytic Chemoselective α-Amination of Acylpyrazoles: A Concise Route to Unnatural α-Amino Acid Derivatives
J. Am. Chem. Soc . 2016 , 138 , 2664–2669. DOI: 10.1021/jacs.5b11773 (Press Release)
